Internationale Konsensus-Konferenz, St. Gallen 2005
Therapie des Mammakarzinoms im Frühstadium
Seit 1978 gibt es die St. Galler Konferenzen zum Mammakarzinom im Frühstadium. Das neunte Treffen fand im Januar 2005 mit 4’166 Teilnehmern aus 78 Ländern statt. Das Herzstück der mehrtägigen Veranstaltung ist die eigentliche Konsensuskonferenz am letzten Tag. Wiederum formulierten international anerkannte Brustkrebsexperten Behandlungsrichtlinien, die seither publiziert wurden [1]. Die Therapieempfehlungen basieren auf der Interaktion von 31 in der Publikation namentlich genannten Experten. Diese stützen ihre Meinungen einerseits auf randomisierte Studien, andererseits und vorab auf den periodisch von englischen Statistikern erarbeiteten „Oxford Overview“, der Daten individueller Patientinnen aus diesen randomisierten Studien zusammenfasst [2]. Die Zusammensetzung des St. Galler Expertengremiums ist bemerkenswert: 5 Frauen und 26 Männer; 19 medizinische Onkologen, 7 Chirurgen (1 davon Gynäkologe), 2 Radio-Onkologen, 2 Statistiker, 1 Pathologe; 19 Europäer, 10 Nordamerikaner, 2 Australier; die Vorsitzenden waren Aron Goldhirsch aus Mailand und John Glick aus Philadelphia. Für die Publikation zeichnen 6 Autoren, 5 davon sind Mitglieder der «International Breast Cancer Study Group» (IBCSG)1 verantwortlich.
Die grosse Neuerung der diesjährigen Therapieempfehlungen gegenüber früheren Konferenzen ist die zentrale Bedeutung, die der Hormonempfindlichkeit («endocrine responsiveness») des Tumors beigemessen wird. Bisher galt das Rückfallrisiko als Hauptkriterium. Im Gegensatz zu diesem rein prognostischen Kriterium wird nun das prädiktive Kriterium ins Zentrum gerückt. Hormonempfindlichkeit bezeichnet das Ausmass der zu erwartenden Wirksamkeit einer endokrinen Therapie. Und dies hat Bedeutung für den Einsatz der endokrinen Therapie wie auch der Chemotherapie. Es werden drei Kategorien gebildet:
1. Hormon-empfindliche Tumore
2. Tumore mit unsicherer Hormonempfindlichkeit
3. Hormon-unempfindliche Tumore.
Erstere können in einzelnen Subgruppen mit endokriner Therapie allein behandelt werden, letztere werden nur mit Chemotherapie behandelt. Die mittlere Gruppe qualifiziert für eine Kombination von endokriner und Chemo-Therapie. Die mittlere Gruppe („unsichere Hormonempfindlichkeit“) wird definiert durch nur geringe Immunreaktivität für Östrogenrezeptoren (unter 10%) und/oder fehlende Progesteron-Rezeptoren). Weitere Merkmale deuten ebenfalls in Richtung „unsichere Hormonempfindlichkeit“ wie die Überexpression von HER2, von Plasminogenaktivator oder von Proliferationsmarkern.
Die neuen Definitionen der Risikogruppen sind in Tabelle 1 zusammengestellt. Obwohl nodale Mikrometastasen (<2 mm) in einzelnen Studien prognostisch relevant waren, sollten sowohl diese wie auch isolierte Tumorzellen in Lymphknoten nicht zur Risikozuteilung verwendet werden. Neu werden Karzinome mit 1 - 3 befallenen Lymphknoten zum intermediären Risiko gezählt, falls sie nicht das HER2-Protein überexprimiert (immunistochemischer Nachweis) oder das HER2-Gen amplifiziert haben (Nachweis durch Fluoreszenz in situ Hybridisierung, FISH). Beim Vorliegen einer peritumoralen vaskulären Invasion gilt ein nodal-negativer Tumor nicht mehr als niederes Risiko.
Tabelle 1: Definition der Risikogruppen (Bild vergrössern: auf Bild klicken)
Die Wahl der systemischen Behandlungsmodalität richtet sich nach der Einschätzung der Hormonempfindlichkeit und des Risikos (Tabelle 2). In der Kategorie mit niederem Risiko gibt es definitionsgemäss keine Karzinome, die hormon-unempfindlich sind. Patientinnen mit hormonempfindlichen Tumoren sollten eine endokrine Therapie erhalten entsprechend ihres menopausalen Status (vgl. Tabelle 3). Beim Vorliegen von Kontraindikationen kann auf eine adjuvante Behandlung verzichtet werden. In der Kategorie mit intermediärem Risiko wird je nach der Einschätzung der Hormonempfindlichkeit eine alleinige endokrine Therapie, eine Kombination einer Chemotherapie mit endokriner Therapie oder eine alleinige Chemotherapie empfohlen (Tabelle 2). In der Kategorie mit hohem Risiko wird in allen Fällen eine Chemotherapie empfohlen, mit oder ohne endokriner Therapie. Auch ältere Patientinnen (über 70 Jahre) ohne Komorbidität können von einer adjuvanten Chemotherapie profitieren.
Tabelle 2: Wahl der Behandlungsmodalität (Bild vergrössern: auf Bild klicken)
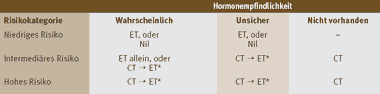 |
| ET = Endokrine Therapie. Nil = keine adjuvante systemische Therapie. CT = Chemotherapie. * Wenn Chemotherapie mit Tamoxifen kombiniert wird, soll letzteres nach Abschluss der Chemotherapie begonnen werden (CT → ET). Bisher gibt es keine Studien zur Frage, wie Aromatasehemmer zeitlich am besten mit Chemotherapie zu kombinieren sind: Konkomittierend (CT + ET) oder sequentiell (CT → ET). Bei prämenopausalen Frauen können GnRH Analoga gleichzeitig mit einer Chemotherapie gegeben werden. | |
| |
Tabelle 3: Behandlungsempfehlungen für «hormonempfindliche» Tumoren (Bild vergrössern: auf Bild klicken)
 |
|
Tam = Tamoxifen, AI = Aromatasehemmer (Anastrozol, Letrozol, Exemestan), CT = Chemotherapie, GnRHA = Gonadotropin-releasing-Hormon Analogon (Goserelin), OS = Ovarielle Suppression. Klammern () zeigen offene Fragen von derzeit laufenden klinischen Studien an. | |
| |
Die endokrine Therapie bei der prämenopausalen Frau ist dadurch kompliziert, dass die Ovarialsuppression zusätzlich zur additiven Hormontherapie bedacht werden muss. Die Ovarialsuppression kann durch GnRHA (Gonadotropin-releasing-Hormon Analoga, z.B. Goserelin), bilaterale Ovarektomie oder «Radiomenolyse» erreicht werden. Oft führt auch schon die adjuvante Chemotherapie besonders bei Frauen über 40 Jahren zur Ovarialsuppression. Als endokrine Therapie bei der prämenopausalen Frau ist Tamoxifen-Monotherapie eine Option. Die alleinige Ovarialsuppression ist dann vertretbar, wenn Tamoxifen kontraindiziert ist. Die Kombination von Tamoxifen plus Ovarialsuppression wird in laufenden Studien (SOFT, TEXT) geprüft. Sie ist sinnvoll bei jungen Patientinnen mit höherem Risiko, besonders wenn durch die Chemotherapie keine Amenorrhoe induziert wurde. Aromatasehemmer können bei der prämenopausalen Frau nicht als Monotherapie eingesetzt werden; in Kombination mit GnRHA sind sie nicht studiert. Die optimale Dauer der Ovarialsuppression ist unbekannt, sollte aber mindestens 2 Jahre betragen.
Zur endokrinen Therapie bei der postmenopausalen Frau sind in den letzten Jahren mehrere Studien mit verschiedenen Aromatasehemmern publiziert worden, die den bisherigen Standard (5 Jahre Tamoxifen) ins Wanken gebracht haben. In der ATAC-Studie wurde gezeigt, dass 5 Jahre Anastrozol das krankheitsfreie Überleben aber nicht das Gesamtüberleben im Vergleich mit Tamoxifen verbessert [3]. Im BIG 1-98 Trial wurde dasselbe für Letrozol gezeigt [4]. Skelettale Nebenwirkungen waren in beiden Studien häufiger unter dem Aromatasehemmer, thromboembolische und gynäkologische Nebenwirkungen häufiger unter Tamoxifen. Zwei grosse Analysen wurden publiziert zum Wechsel von Tamoxifen auf einen Aromatasehemmer nach 2 - 3 Jahren im Vergleich mit der Fortsetzung der adjuvanten Tamoxifen-Therapie für 5 Jahre. Die kombinierte Analyse einer deutschen und einer österreichischen Studie bei 3’123 Patientinnen fand eine Verbesserung des rückfallsfreien Überlebens durch den Wechsel auf Anastrozol nach 2 Jahren Tamoxifen [5]. Die (vorwiegend britische) IES-Studie bei 4’742 Patientinnen fand einen Vorteil im krankheitsfreien Überleben durch den Wechsel auf Exemestan nach 2 - 3 Jahren [6]. Eine nordamerikanische Studie (MA-17) verglich bei 5’157 Patientinnen nach 5 Jahren Tamoxifen den Wechsel auf Letrozol mit Placebo und fand einen Vorteil im krankheitsfreien und Gesamtüberleben bei den nodal-positiven Patientinnen, hingegen nur einen Vorteil im krankheitsfreien Überleben bei den nodal-negativen Patientinnen [7]. Auf der Basis dieser Studienergebnisse hat eine amerikanische Kommission empfohlen, dass die adjuvante Behandlung einer postmenopausalen Patientin mit einem hormonempfindlichen Mammakarzinom einen Aromatasehemmer einbeziehen sollte, entweder als initiale Therapie oder nach einer Behandlung mit Tamoxifen [8]. Wann der Wechsel erfolgen soll und wie stark die skelettalen und kardiovaskulären Nebenwirkungen der Aromatasehemmer zu gewichten sind, wird heute immer noch kontrovers diskutiert.
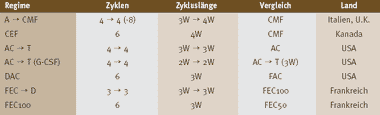
Tabelle 4: Adjuvante Chemotherapien (Bild vergrössern: auf Bild klicken)
 |
|
A = Doxorubicin, C = Cyclophosphamid, D = Docetaxel, E = Epirubicin, F = Fluorouracil, G-CSF = Filgrastim, M = Methotrexat,
T = Paclitaxel
Jede Zeile fasst eine oder mehrere randomisierte Studien zusammen, die einen gewissen Vorteil für das Regime in der ersten
Kolonne ergeben haben. Diese Regime kommen in Frage für hohes oder intermediäres Risiko, währenddem die weniger belastenden Regime in der Kolonne «Vergleich» in Frage kommen für intermediäres Risiko. | |
| |
Noch umstrittener ist die Situation bei der adjuvanten Chemotherapie (vgl. Tabelle 4). Die vorliegenden Daten aus über 200 randomisierten Studien und 4 Metaanalysen werden unterschiedlich gewertet [1]. Vereinfachend kann man die Situation so beschreiben: Ausgangspunkt ist CMF bzw. das ihm ebenbürtige, gut verträgliche amerikanische Regime 4 Zyklen AC (Doxorubicin/Cyclophosphamid). Gegenüber diesen Basistherapien haben verschiedene modernere Regime einen Überlebensvorteil gezeigt, die alle mindestens 6 Therapiezyklen beinhalten (Tabelle 4). Einzelne europäische Experten sehen den Vorteil in der längeren Therapiedauer, amerikanische Experten sind hingegen überzeugt, dass die Zugabe von Taxanen notwendig ist. Die neueren Regime sind toxischer als CMF und AC, die immer noch bei nodal-negativen Patientinnen eingesetzt werden. Vier Zyklen Doxorubicin (oder Epirubicin) gefolgt von 4 - 8 Zyklen CMF sind besser als 6 Zyklen CMF allein. Das wurde in Mailand vor 15 Jahren gezeigt und in Grossbritannien vor kurzem bestätigt. Auch das Anthrazyklin-haltige kanadische CEF (Cyclophosphamid, Epirubicin, Fluorouracil) ist dem CMF überlegen. Die Zugabe von 4 Zyklen Paclitaxel zu 4 Zyklen AC (AC®T) ergibt einen Vorteil. Die Verkürzung des Zyklusintervalls im AC®T von 3 Wochen auf 2 Wochen durch den Einsatz von GCS-F (Filgrastim) ergibt einen kleinen Vorteil. Wegen der hohen Kosten des Wachstumsfaktors hat sich dieses Regime nicht durchsetzen können. Sechs Zyklen DAC (Docetaxel, Doxorubicin, Cyclophosphamid) sind besser als 6 Zyklen FAC (Fluorouracil, Doxorubicin, Cyclophosphamid). In Frankreich wurde die Überlegenheit von FEC100 (Fluorouracil, Epirubicin 100 mg/m2 pro Zyklus, Cyclophosphamid) gegen FEC50 (Epirubicin 50 mg/m2 pro Zyklus) nachgewiesen und zum neuen Standard erhoben. FEC®D (3 Zyklen FEC100, gefolgt von 3 Zyklen Docetaxel) ist etwas besser als FEC100. Insgesamt werden alle in Tabelle 4 zusammengestellten Regime verwendet, wobei die Gründe für das eine oder andere verschiedener Natur sein können: wissenschaftliche Glaubwürdigkeit, nationale Gepflogenheit, Praktikabilität, Verträglichkeit, Präferenz der Patientin, Kosten. Die Erkenntnis, dass die Chemotherapie bei hormon-unempfindlichen Karzinomen weit besser wirkt als bei hormon-empfindlichen, setzt sich zunehmend durch. Es ist möglich, dass die intensiveren und belastenderen Regime nur bei den hormon-unempfindlichen Karzinomen überlegen sind, währenddem hormon-empfindliche Tumore ebenso gut mit einer weniger intensiven Chemotherapie in Kombination mit der endokrinen Therapie zu behandeln sind.
Bei der adjuvanten Radiotherapie hat sich wenig gegenüber früheren Konsensus-Konferenzen geändert. Sie wird nicht parallel, sondern sequentiell nach der adjuvanten Chemotherapie verabreicht, kann aber gleichzeitig mit Tamoxifen (und auch Trastuzumab) gegeben werden.
Seit der Konsensus-Konferenz im Februar 2005 sind schon wieder neue relevante Daten zur adjuvanten Therapie des Mammakarzinoms vorgestellt und auch publiziert worden. Diese werden an anderer Stelle in diesem Heft als Studienbesprechung vorgestellt [s. Artikel von T. Rordorf].
Besprechung von PD. Dr. med. Bernhard Pestalozzi,
Klinik und Poliklinik für Onkologie, Universitätsspital Zürich
Referenzen
1. Goldhirsch A, Glick JH, Gelber RD, Coates AS, Thurlimann B, Senn HJ & Panel Members. Meeting highlights: international expert consensus on the primary therapy of early breast cancer 2005. Ann Oncol 2005;16:1569-1583
2. Early Breast Cancer Trialists’Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005;365:1687-717.
3. Howell A, Cuzick J, Baum M et al. Results of the ATAC (Arimidex, Tamoxifen, Alone or in Combination) trial after completion of 5 years’ adjuvant treatment for breast cancer. Lancet 2005;365:60-62.
4. The Breast International Group (BIG) 1-98 Collaborative Group. A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer. N Engl J Med 2005;353:2747-57.
5. Jakesz R, Kaumann M, Gnant M et al. Switching of postmenopausal women with endocrine-responsive early breast cancer to anastrozole after 2 years’ adjuvant tamoxifen: combined results of ABCSG trial 8 and the ARNO 95 trial. Lancet 2005;366:455-62.
6. Coombes RC, Hall E, Gibson LJ et al. A randomized trial of exemestane after two to three years of tamoxifen therapy in postmenopausal women with primary breast cancer. N Engl J Med 2004;350:1081-92 [Erratum, N Engl J Med 2004;351:2641]
7. Goss PE, Ingle JN, Margino S et al. Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor-positive breast cancer: updated findings from NCIC CTG Ma.17. J Natl Cancer Inst 2005;97:1262-71.
8. Winer EP, Hudis C, Burstein HJ et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol 2005;23:619-629.
| |
| Medizin Spektrum |
|
| 19-01-2006 - ssc |
| |
 |
|